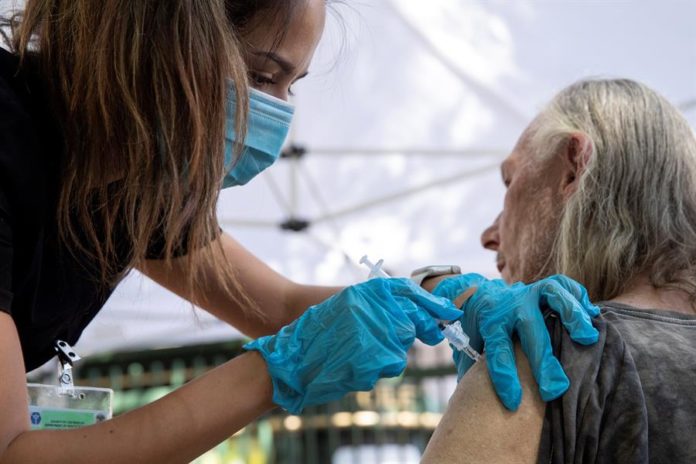
Hasta el 22 de septiembre, 1.580 habitantes más habían sido diagnosticados con COVID-19 en la ciudad. De acuerdo con datos del Departamento de Salud, hasta entonces se habían reportado 280 nuevos casos por día que es ligeramente más alto que la semana pasada, pero aun por debajo del pico de hace algunas semanas. El 83.6 % de los adultos han recibido al menos una dosis, y el 68.8 % de los adultos están ya completamente vacunados, lo que significa que se podría tener el 70 % de los adultos completamente vacunados en la ciudad alrededor del 1 de octubre, lo que representa alcanzar la esperada inmunidad de rebaño y considerar el posible fin de la pandemia en la ciudad. Asimismo, se reportó que 46.500 adolescentes entre 12 y 17 años han recibido al menos una dosis de la vacuna. La Dra. Cheryl Bettigole, comisionada de salud interina, anunció también que en los pasados nueve meses se han administrado más de dos millones de vacunas, en un esfuerzo sin precedente por parte de las autoridades sanitarias y población en general.
VACUNA PARA LOS NIÑOS
El 20 de septiembre Pfizer, BioNTech SE, y Nueva York y Mainz, Alemania, anunciaron que su vacuna COVID-19 parece ser segura y efectiva en niños de 5 a 11 años. Estas empresas ya planean enviar los datos a la FDA (U.S. Food, Drug Administation), EMA (European Medicines Agency) y otras agencias reguladoras de todo el mundo lo antes posible.
La Dra. Bettigole, mencionó al respecto, “estamos esperando ansiosamente la orientación de la FDA y los CDC sobre cómo y cuándo podremos comenzar a vacunar a los niños de esta edad. Hasta que obtengamos esa orientación, los niños de 5 a 11 años nos son elegibles aún para ser vacunados. Mientras tanto, la mejor manera de proteger a los niños no vacunados es asegurarse de que todos los que los rodean a partir de los 12 años estén completamente vacunados”.
Los resultados en niños menores de 5 años se esperan a finales del 2021.
“Nos complace poder enviar datos a las autoridades reguladoras para este grupo de niños en edad escolar antes del inicio de la temporada de invierno”, dijo el Dr. Ugur Sahin, director ejecutivo y cofundador de BioNTech. “El perfil de seguridad y los datos de inmunogenicidad en niños de 5 a 11 años vacunados con una dosis más baja son consistentes con los que hemos observado con nuestra vacuna en otras poblaciones mayores con una dosis más alta”.
TERCERA DOSIS
El Departamento de Salud Pública y servicios Humanos de los Estados Unidos anunció desde el 1 de septiembre que está planificando la aplicación de una dosis de refuerzo, para que las personas vacunadas mantengan la protección en los próximos meses, y ya se están preparando logísticamente los encargados de distribuirla y de aplicarla.
JOHNSON & JOHNSON TODAVÍA NO
Es probable que las personas que recibieron la vacuna de J&J necesiten una dosis de refuerzo. Sin embargo, como esta vacuna no empezó a aplicarse en el país hasta pasados los 70 días de las primeras vacunas de ARNm (Pfizer/BioNTech y Moderna) todavía no se cuenta con los datos necesarios disponibles para tomar esta decisión. Los CDC mantendrán informado al público con un plan oportuno para las dosis de refuerzo de las vacunas de J&J, pero los estudios recientes si han visto que los que recibieron una dosis de refuerzo después de dos meses de su aplicación, aumentaron su inmunidad hasta la misma variante Delta, en más de un 90 por cierto.
EE. UU. aprueba la tercera dosis de Pfizer para mayores de 65 años y otros casos
La Administración de Alimentos y Medicamentos (FDA, en inglés) de Estados Unidos, el ente que regula la comercialización de fármacos autorizó el pasado miércoles una tercera dosis de la vacuna de Pfizer para los mayores de 65 años y también para mayores de edad en riesgo de salud o especialmente expuestos a la COVID-19.
Este último grupo de personas especialmente expuestas consiste en los trabajadores de la salud, profesores, cuidadores, empleados de supermercados, personas sin hogar y privadas de libertad, según detalló la FDA en un comunicado donde la directora del organismo, Janet Woodcock afirmó que a medida que se tenga más información sobre «la seguridad y eficacia» de las vacunas, incluyendo las terceras dosis, la FDA «evaluará» esa información.
Esta decisión de la FDA llega en pleno debate en Estados Unidos sobre la necesidad de administrar una tercera dosis a toda su población y a nivel mundial sobre la idoneidad de hacerlo mientras otros países aún no tienen suficientes vacunas.
La autorización de la tercera dosis para estos grupos de personas llega una semana después de que lo recomendara un comité de asesores de la FDA.
La recomendación se tomó en una segunda votación tras haber rechazado previamente, con amplio respaldo, el plan de una tercera dosis para la mayoría de la población, al considerar insuficientes las pruebas para administrar una tercera dosis a todo el mundo.
De este modo se restringe la petición de Pfizer, que había solicitado la aprobación para las personas mayores de 16 años de este refuerzo, seis meses después de la segunda dosis.
Esa recomendación supone un toque de atención para el Gobierno de Joe Biden, que había dado su apoyo explícito a la propuesta de Pfizer y comenzado a hacer planes para iniciar la administración de esta tercera dosis a los mayores de 16 años con la vista puesta en el 20 de septiembre.
En un comunicado, el consejero delegado de Pfizer, Albert Bourla, afirmó que «los refuerzos de la vacuna tienen un papel importante que desempeñar para abordar la amenaza continua de esta enfermedad» y consideró la decisión de la FDA como un «hito crucial» en la lucha contra la COVID-19.
La de Pfizer es la única vacuna que cuenta con aprobación total para su uso por parte de la FDA, ya que las de Moderna y Johnson & Johnson cuentan solo con autorización de emergencia.




















